Aspirina
Você sabe de onde vem a aspirina? Da casca do salgueiro! Difícil acreditar, né? Mas, o uso da casca do salgueiro para o tratamento de dores é conhecido desde a Antiguidade.
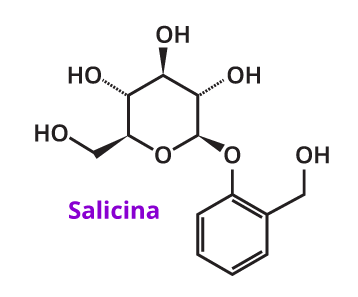
O ácido acetilsalicílico, popularmente conhecido como aspirina, foi desenvolvido a partir da salicina, uma substância extraída da casca de uma árvore chamada salgueiro ou chorão1. É um medicamento utilizado para o tratamento de dor e febre.
Medicamentos são produtos farmacêuticos usados para tratar problemas de saúde. Por exemplo, para aliviar uma dor de cabeça. Lembre-se sempre, devem ser receitados por médicos.
A química tem um papel muito importante no desenvolvimento de medicamentos seguros e eficazes.1,2 A produção de aspirina é um exemplo da importância dos processos de síntese na vida cotidiana.
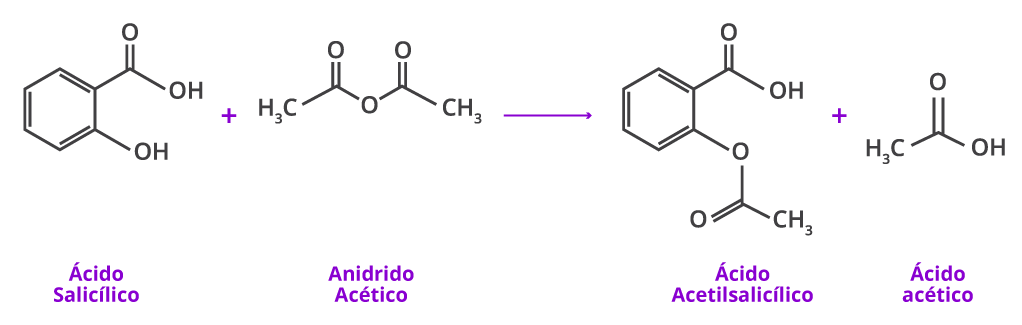
Para sintetizar um composto, é preciso conhecer os materiais de partida, as condições de reação e os produtos que serão formados.2 A síntese da aspirina ocorre na presença de reagentes em excesso e catalisadores3, conforme reação abaixo:
Hoje em dia, a área da química conhecida como Química Verde estuda formas de melhorar a síntese da aspirina3. Do uso da casca do salgueiro para o tratamento de dores até a sua síntese em laboratório e fabricação em escala industrial, a aspirina percorreu um longo caminho. Saiba mais sobre o contexto histórico de desenvolvimento da aspirina com a leitura do texto a seguir.
História de desenvolvimento da aspirina
O uso da casca do salgueiro para alívio da dor remonta à Antiguidade. Hipócrates, conhecido como o “pai da medicina”, usava extratos de casca de salgueiro para baixar a febre e aliviar a dor. Dioscorídes, cirurgião grego do exército romano, observou que as folhas de salgueiro reduziam a inflamação.4,8
Em 1763, Edward Stone, um clérigo de Oxfordshire, relatou uma preparação com a casca de salgueiro seca para tratar a febre.6
Em 1828, Johann Buchner isolou da casca do salgueiro cristais amarelos que chamou de salicina (em homenagem a Salix, o gênero do salgueiro). Em 1829, o procedimento de extração da salicina foi refinado por Pierre-Joseph Leroux. Em 1838, o italiano Raffaele Piria produziu o ácido salicílico.4,5,6,7
Em 1852, o químico francês Charles Gerhardt, modificou o ácido salicílico com a introdução de um grupo acetil no lugar de um grupo hidroxila. Porém, o composto produzido não era estável.5
Em 1876, Thomas John MacLagan, médico escocês da Dundee Royal Infirmary, investigou os efeitos da salicina no alívio dos sintomas da febre reumática.5,7
Em 1897, os químicos da Bayer produziram o ácido acetilsalicílico a partir do ácido salicílico derivado da planta meadowsweet em vez da casca do salgueiro.5,6 Há controvérsias sobre quem foi o principal responsável pela produção de aspirina. Essa síntese é creditada oficialmente ao químico alemão Felix Hoffmann que trabalhava na Bayer.5,6
A motivação de Hoffmann foi despertada por sua preocupação com o pai, que sofria de dores reumáticas. 4,6 O salicilato de sódio ajudava a reduzir a dor, mas causava graves irritações para o revestimento do estômago. 6 A ideia de Hoffmann era reduzir os efeitos colaterais do salicilato de sódio usado no tratamento das dores.6 Em 1897, Hoffmann descreveu a síntese do ácido acetilsalicílico.5,6 O composto foi chamado de aspirina, uma combinação de “A”de acetilação, “spir” da planta Spiraea ulmaria e “in” sufixo empregado com freqüência em medicamentos naquela época.8
No entanto, há disputas sobre o principal responsável pelo desenvolvimento da aspirina.5,6 Arthur Eichengrün, químico e chefe da divisão farmacêutica da Bayer, era responsável pelo desenvolvimento de novos medicamentos. Em 1897, Eichengrün decidiu pesquisar uma forma de salicilato que não causava irritação gástrica e atribuiu esta tarefa a Hoffmann.5,6 Ao receber essa tarefa de Eichengrün, Hoffmann começou a trabalhar manipulando o ácido salicílico extraído das folhas de meadowsweet.5
Heinrich Dreser, chefe da seção de farmacologia e responsável pelos ensaios clínicos, inicialmente rejeitou os resultados dos testes. Eichengrün não aceitou a rejeição e realizou seus próprios ensaios clínicos. No entanto, após o chefe da unidade solicitar novos testes, Dreser aceitou a produção de ácido acetilsalicílico.5
Enquanto Hoffmann e Eichengrün não receberam royalties pelo desenvolvimento da aspirina, Dreser recebeu royalties por todos os medicamentos em seu laboratório.5
Eichengrün deixou a Bayer para abrir sua própria empresa química. Em 1944 foi enviado para o campo de concentração de Theresienstadt onde permaneceu até que os russos o libertassem em 1945.
A aspirina foi comercializada pela Bayer, porém pouco se conhecia sobre seu mecanismo de ação.5,6 John Vane e colegas demonstraram que a aspirina inibia a produção de prostaglandinas (compostos lipídicos). Vane foi premiado com o Nobel de medicina em meados de 1970.1,5
Atualmente, a aspirina é amplamente comercializada no mundo.
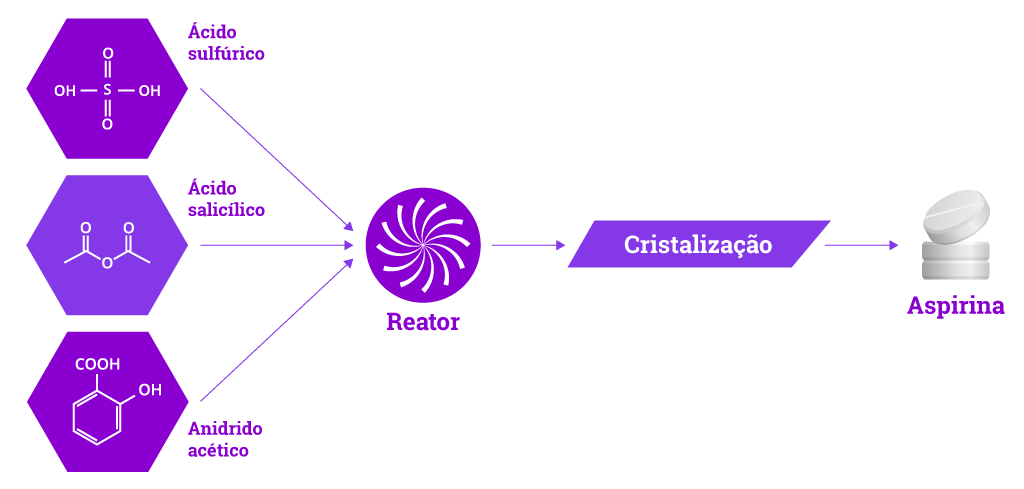
Os fármacos sintéticos podem ser obtidos em dois tipos de escala. A escala de bancada é aquela aplicada no desenvolvimento da rota sintética, para chegar ao composto planejado, em pequenas quantidades, mas suficientes para investigar o seu perfil farmacológico. Já a semi-industrial, é uma adaptação da primeira rota sintética visando a obtenção do fármaco em maior escala1.
Atividade para aprofundar
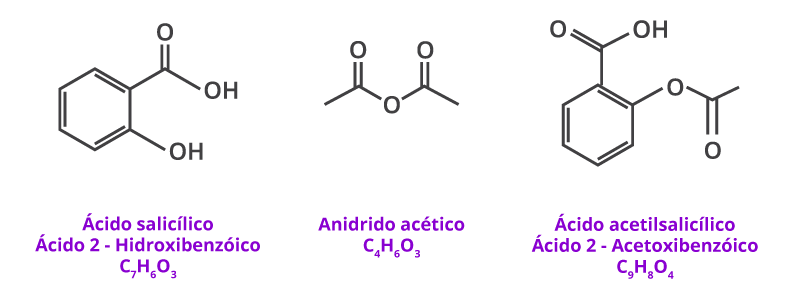
(1) Escreva a fórmula estrutural plana, para cada um dos compostos, evidenciando todas as ligações químicas.
(2) Quais são os grupos funcionais presentes no ácido salicílico, no anidrido acético e no ácido acetilsalicílico?
Referências
1 – Menegatti, R.; Fraga, C. A. M.; Barreiro, E. K. A Importância da Síntese de Fármacos. Cadernos Temáticos de Química Nova na Escola, n. 3, maio, 2001. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/03/sintese.pdf>
2 – The Wolfson Foundation. Synthesis and Analysis. Teacher Notes. Royal Society of Chemistry. 2011.
3 – Domingues, L. A.; MAGALHÃES, C. G.; Sandri, M. C. M. Síntese do Ácido Acetilsalicílico: Uma proposta para laboratórios de Graduação empregando a Química Verde. Química Nova na Escola, v. 44, n. 2. P. 105-114, maio, 2022.
4 – LE COUTEUR, P.; BURRESON, J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Rio de Janeiro: Zahar, 2006. 343p.
5 – Desborough, M. J. R.; Keeling, D. M. The aspirin story – from willow to Wonder drug. British Journal of Haematology, v. 177, p. 674-683, 2017. Disponível em: <https://onlinelibrary.wiley.com/doi/10.1111/bjh.14520>
6 – Wood, J.N. From plant extract to molecular panacea: a commentary on Stone (1763) ‘An account of the success of the bark of the willow in the cure of the agues’. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, v. 370, n. 1666, abril, 2015. Disponível em:<https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4360122/>
7 – Doyle, D.Thomas MacLagan’s 1876 demonstration of the dramatic effects of salicin in rheumatic fever. Journal of the Royal Society of Medicine, v. 107, n. 7, p. 287-289, julho, 2014. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4093759/>
8 – Luengo, M. B. A historical revision of the main immunological events and pharmacology in the search of the understanding and treatment of inflammatory diseases. Revista Eletrônica de Farmácia, v.2, n.2, p. 64-72, 2005. Disponível em: <https://revistas.ufg.br/REF/article/view/1954>
Desenvolvimento da página
Pesquisador: Patricia Link Rüntzel
Design: Taina Bueno
Agradecimentos: Prof.ª Dra Marilei Mendes Casturina Sandri
Ao Projeto CNPq Pró-Humanidades 420046/2022-4 – Quimidex Ambiental – Ciência para o Desenvolvimento Sustentável








 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.