Perfumes, Aromas e Sabores: Uma química inesquecível.
Este ambiente temático costumava ter um espaço reservado no Quimidex, no entanto passará a ser virtual. Em breve você encontrará mais informações aqui. Enquanto isso, você pode visitar o ambiente temático Química Verde 🙂

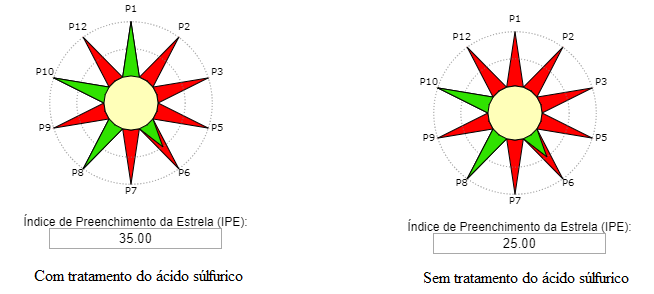

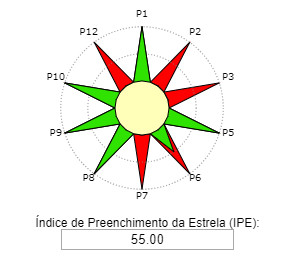



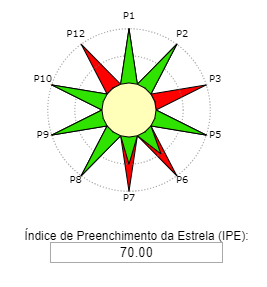
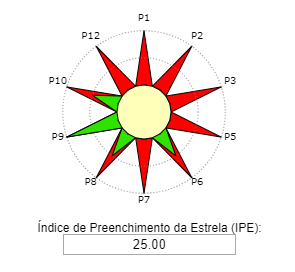

Consulte o roteiro experimental abaixo:
 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Isolamento: Após 2 horas de aquecimento, colocou-se a mistura de reação em um funil de separação, adicionando-se cuidadosamente 100 mL de água. A fase aquosa (inferior) foi desprezada e a fase orgânica foi lavada 2 vezes com 50 mL de solução saturada de bicarbonato de sódio. Desprezou-se novamente a fase aquosa e lavou-se a fase orgânica com 25 mL de água. O éster bruto foi transferido para um béquer, ao qual se adicionou sulfato de sódio ou sulfato de magnésio anidro.
Informações adicionais. A lavagem com a solução aquosa de hidrogenocarbonato de sódio tem como objetivo remover a máxima quantidade de ácido acético, visível através da libertação de dióxido de carbono
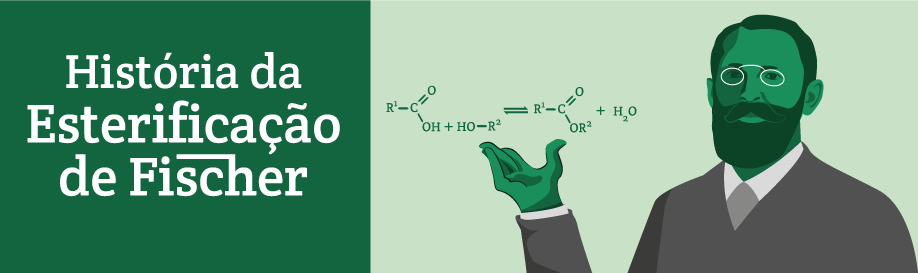 Os aromas sempre fizeram parte da história da humanidade. Atualmente, os aromas são muito importantes para a indústria de alimentos. Os aromas tem a função dar gosto e cheiro aos alimentos industrializados. No laboratório, é possível sintetizar um aroma idêntico ao encontrado na natureza. Os ésteres, por exemplo, são encontrados em flores e frutas, proporcionando um odor agradável. Através de reações químicas de síntese no laboratório, é possível obter os ésteres que conferem odor agradável as flores e frutas. A síntese química dos ésteres através do processo de esterificação é a mais comum. Em 1985, Emil Fischer e Arthur Speier escreveram pela primeira vez sobre a síntese dos ésteres. Mais tarde, essa síntese ficou conhecida como a esterificação de Fischer-Speier. Em seus experimentos, foram utilizados metanol (álcool metílico) e etanol (álcool etílico). O ácido sulfúrico e o ácido clorídrico foram utilizados como reagentes auxiliares nos seus experimentos. O químico alemão Leopold Gmelin cunhou o termo éster na primeira metade do século XIX.
Os aromas sempre fizeram parte da história da humanidade. Atualmente, os aromas são muito importantes para a indústria de alimentos. Os aromas tem a função dar gosto e cheiro aos alimentos industrializados. No laboratório, é possível sintetizar um aroma idêntico ao encontrado na natureza. Os ésteres, por exemplo, são encontrados em flores e frutas, proporcionando um odor agradável. Através de reações químicas de síntese no laboratório, é possível obter os ésteres que conferem odor agradável as flores e frutas. A síntese química dos ésteres através do processo de esterificação é a mais comum. Em 1985, Emil Fischer e Arthur Speier escreveram pela primeira vez sobre a síntese dos ésteres. Mais tarde, essa síntese ficou conhecida como a esterificação de Fischer-Speier. Em seus experimentos, foram utilizados metanol (álcool metílico) e etanol (álcool etílico). O ácido sulfúrico e o ácido clorídrico foram utilizados como reagentes auxiliares nos seus experimentos. O químico alemão Leopold Gmelin cunhou o termo éster na primeira metade do século XIX.

O motor a óleo diesel deve-se a invenção do engenheiro Rudolf Diesel. Diesel desenvolveu um motor de ignição por compressão de ar. Nesse caso, a ignição do combustível ocorre em função da alta temperatura e pressão alcançada através da compressão do ar no motor. Esse processo ocorre antes do combustível ser injetado no cilindro do motor.
Durante a exposição mundial de Paris de 1900, a companhia francessa Otto apresentou um pequeno motor diesel movido com óleo vegetal de amendoim. Em princípio, o motor diesel foi desenvolvido para operar utilizando óleo mineral como combustível. A ideia de se utilizar óleos vegetais como combustível partiu do governo francês. Na época, o governo francês produzia grandes quantidades de amendoim em colônias africanas.
Inicialmente, os óleos vegetais foram testados como combustíveis na sua forma in natura. Porém, a viscosidade dos óleos vegetais era muito maior que a do óleo diesel e causava muitos problemas operacionais. A reação de transesterificação apresentou-se como uma solução para o problema da viscosidade dos óleos vegetais. O primeiro relato do que hoje é conhecido como biodiesel é de uma patente Belga de 1937, registrada em nome do pesquisador Charles Chavanne da Universidade de Bruxelas. Chavanne propôs usar a reação de transesterificação de ésteres etílicos obtidos do óleo de palma em meio ácido. Ressalta-se que o termo biodiesel foi publicado pela primeira vez em um trabalho chinês de 1988.
A utilização de biodiesel no Brasil teve início na década de 1970 e atualmente é o quarto maior produtor mundial desse biocombustível.

A fabricação de sabão é uma das atividades mais antigas da nossa civilização. É provável que o processo de fabricação de sabão tenha sido uma descoberta acidental. Cilindros de barro, datados de aproximadamente 2800 a.C., contendo um material parecido com sabão foram encontrados durante escavações na Babilônia. Os registros revelam que os habitantes do local ferviam gordura animal misturada com cinzas.
Registros do Egito Antigo, datados de aproximadamente 1500 a.C., mostram que os egípcios usavam um material parecido com sabão para banho e tratamento de doenças de pele.
Segundo uma lenda romana, o sabão teria sua origem do Monte Sapo. O Monte Sapo era o lugar onde se sacrificavam os animais. As águas da chuva se misturavam com a gordura dos animais e as cinzas das fogueiras dos altares de sacrífico. As chuvas levavam essa mistura até as margens do rio Tibre. As mulheres que lavavam roupas as margens do rio Tibre, observaram que as roupas ficavam muito mais limpas quando lavadas próximo ao local do rio que continha a mistura.
Em 1971, o químico francês Nicolas Leblanc (1742-1806), desenvolveu a síntese do carbonato de sódio. A produção de carbonato de sódio foi um passo muito importante para a fabricação de sabão comercial. O carbonato de sódio é uma das substâncias que fazem parte da composição das cinzas. As cinzas reagim com a gordura para fazer o sabão.
Atualmente, a fabricação de sabões e detergentes sintéticos compõem as atividades da indústria química.

O nylon foi a primeira fibra têxtil sintética produzida. Foi desenvolvido pelo químico orgânico Wallace Carothers contratado pela Du Pont Fibersilk Company. Em 1928, Carothers começou a trabalhar no laboratório da Du Pont com oportunidade de realizar pesquisa independente e com orçamento quase ilimitado. Carothers decidiu trabalhar com polímeros e menos de um ano depois de pesquisa no laboratório Du Pont, havia feito uma molécula poliéster com peso molecular de mais de 5.000. Depois, conseguiu elevar esse valor para 12.000, mostrando que polímeros eram moléculas gigantes (Hermann Staudinger foi um químico alemão que defendia que os polímeros eram moléculas extramamente grandes. Em 1953 recebeu o Prêmio Nobel de Química). Durante 4 anos, Carothers e seus colegas prepararam diferentes tipos de polímeros com diferentes propriedades, até obter o nylon. Em 1938, o nylon foi inicialmente usado nas cerdas da escova de dente. No ano seguinte, meias de nylon fizeram sucesso no mercado. Tinha muitas propriedades da seda e era muito mais barato. Com sua resistência, durabilidade e leveza passou rapidamente a ser usado em outros produtos: vestuário em geral, redes e linhas de pesca, cordas para raquetes de tênis e revestimento para fios eletrônicos.
Fonte: COUTEUR, l. P.; BURRESON, J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Portugal: Rio de Janeiro: Zahar, 2006.
Consulte o roteiro experimental abaixo:
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Isolamento: Após 2 horas de aquecimento, colocou-se a mistura de reação em um funil de separação, adicionando-se cuidadosamente 100 mL de água. A fase aquosa (inferior) foi desprezada e a fase orgânica foi lavada 2 vezes com 50 mL de solução saturada de bicarbonato de sódio. Desprezou-se novamente a fase aquosa e lavou-se a fase orgânica com 25 mL de água. O éster bruto foi transferido para um béquer, ao qual se adicionou sulfato de sódio ou sulfato de magnésio anidro.
Informações adicionais. A lavagem com a solução aquosa de hidrogenocarbonato de sódio tem como objetivo remover a máxima quantidade de ácido acético, visível através da libertação de dióxido de carbono
Consulte o roteiro experimental abaixo:
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Isolamento: Após 2 horas de aquecimento, colocou-se a mistura de reação em um funil de separação, adicionando-se cuidadosamente 100 mL de água. A fase aquosa (inferior) foi desprezada e a fase orgânica foi lavada 2 vezes com 50 mL de solução saturada de bicarbonato de sódio. Desprezou-se novamente a fase aquosa e lavou-se a fase orgânica com 25 mL de água. O éster bruto foi transferido para um béquer, ao qual se adicionou sulfato de sódio ou sulfato de magnésio anidro.
Informações adicionais. A lavagem com a solução aquosa de hidrogenocarbonato de sódio tem como objetivo remover a máxima quantidade de ácido acético, visível através da libertação de dióxido de carbono

