Síntese de um combustível alternativo: biodiesel
Origem da matéria-prima biodiesel x diesel
Os triglicerídeos são a matéria-prima para a produção do biodiesel. Podem ser desde óleos vegetais até gordura animal. Já no caso do diesel, sua origem é de matéria-prima não renovável.

Clique aqui para conhecer a história do desenvolvimento do biodiesel
Produção do Biodiesel
O principal método de produção de biodiesel é a reação de transesterificação. Óleos e gorduras de origem animal ou vegetal (triacilglicerídeos) reagem com um álcool de cadeia carbônica curta na presença de um catalisador para formar biodiesel (produto da reação) e glicerol/glicerina (co-produto da reação).
A reação de transesterificação pode ser escrita conforme figura abaixo, onde R representa uma cadeia carbônica longa, característica dos ácidos graxos que compõem os triacilgliceróis constituintes dos óleos e gorduras e R1′ representa uma cadeia carbônica curta, característica do álcool utilizado para conduzir a transesterificação.

Representação simplificada para a reação de transesterificação.
Observe que neste processo, 1 mol de triacilglicerol (óleo ou gordura) reage com 3 mols de álcool, usualmente metanol ou etanol, na presença de um catalisador para formar 3 mols de biodiesel e 1 mol de glicerol (BOTELHO, 2011). As reações de transesterificação são realizadas com álcool em excesso. No Brasil, é utilizado principalmente o etanol, um álcool obtido da cana-de-açúcar. Nesse caso, se o álcool utilizado para a transesterificação for o etanol, pode-se considerar o biodiesel com 100% de fonte renovável (BOTELHO, 2012).
Podemos calcular as massas molares para a reação de transesterificação metílica e etílica de 1 mol de triacilglicerol.
Vejamos o exemplo do óleo de soja:
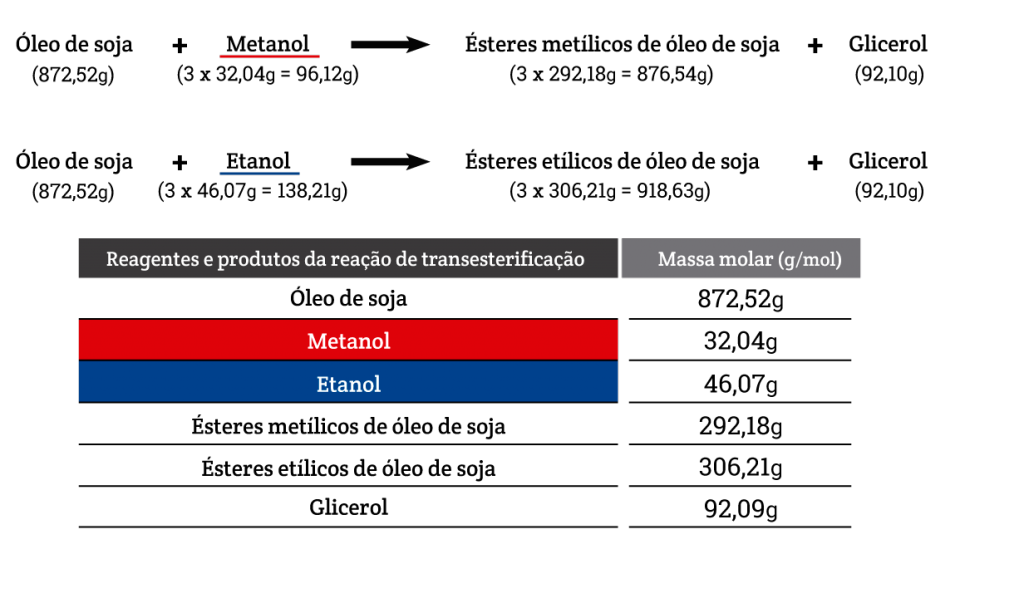
Mantendo as proporções estequiométricas (3:1 – três mols de álcool para um mol de óleo), considere a produção de biodiesel a partir de 1 tonelada de óleo de soja. Quanto de álcool é necessário para reagir com o óleo de soja?


Em relação a produção industrial de biodiesel, a proporção molar 3:1 (álcool:triacilglicerol) não é suficiente para promover uma conversão satisfatória dos óleos e gorduras em ésteres metílicos e etílicos (BOTELHO, 2012). Para que sejam atingidas boas taxas de conversão, a reação deve ser conduzida utilizando um excesso molar de álcool (BOTELHO, 2012). O excesso de álcool é um dos principais fatores que afetam o rendimento da reação de transesterificação e depende do tipo de álcool e catalisador utilizado no processo.
Pesquisas mostram que quando o metanol é utilizado como álcool, a proporção molar 6:1 (álcool:triacilgliceróis) promove maior rendimento da reação.

Fonte: Freedman et al (1984)
Quando o etanol é utilizado como álcool transesterificante, as pesquisas mostram que a proporção molar etanol:triacilgliceróis deve ser maior do que 6:1. O etanol é menos reativo do que o metanol para conduzir a reação de transesterificação. A tabela a seguir, ilustra dados de estudos da transesterificação etílica do óleo de soja refinado utilizando catalisadores básicos (BOTELHO, 2012).

De acordo com a tabela, a proporção molar 12:1 é observado maior rendimento.
Degradabilidade
O biodiesel é um combustível facilmente biodegradável em ambientes aquáticos e terrestres. Sua toxidade é consideravelmente menor do que a do óleo diesel mineral. Assim, quando comparado ao óleo diesel mineral, o biodiesel provoca impactos ambientais significativamente menores em casos de derramamentos ou vazamentos acidentais (BOTELHO, 2012).
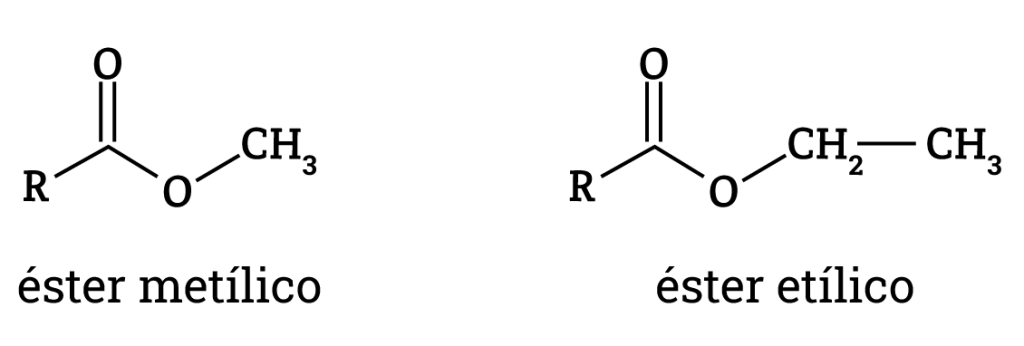
“Os ésteres etílicos são mais facilmente biodegradados no meio aquático do que os ésteres metílicos, apresentando por isso menos riscos ambientais” (BOTELHO, 2012, p.50 citando Makareviciene; Janulis, 2003).
Referências
BOTELHO, C. A. V. A. Viabilidade técnica e aspectos ambientais do biodiesel etílico de óleos residuais de fritura. 2012. 123f. Dissertação (Mestrado em Ciências) – Programa de Pós-Graduação em Energia, Universidade de São Paulo, São Paulo, 2012.
DABDOUB, M. J.; BRONZEL, J. L.; RAMPIN, M. A. Biodiesel: visão crítica do status atual e perspectivas na academia e na indústria. Química Nova, .32, nº3, p.776-792, 2009.
FREEDMAN, B.; MOUNTS, T. L.; PRYDE, E. H. Variables Affecting the Yields of Fatty Esters from Transesterified Vegetable Oils. Journal of the American Oil Chemists Society, n.61, p.1638-1643, 1984.
RAMOS, L. P.; SILVA, F. R.; MANGRICH, A. S.; CORDEIRO, C. S.. Tecnologias de Produção de Biodiesel. Revista Virtual Química, v.3, nº5, p.385-405, 2011.
Anterior







 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.