Óleo essencial de laranja
O que são óleos essenciais?
Você já ouviu falar de óleos essenciais? Se você nunca ouviu falar de óleos essenciais, muito provavelmente já sentiu o cheiro de alguns deles. Os óleos essenciais são empregados na indústria alimentícia, farmacêutica, de cosméticos e produtos de limpeza.
Por que as plantas produzem óleos essenciais?
Os componentes dos óleos essenciais são produzidos pelas plantas como uma estratégia de sobrevivência, autodefesa e atração7.
Óleo vegetal e óleo essencial: são diferentes?
Ambos os óleos são extraídos de plantas. Uma das principais diferenças entre esses óleos está na composição. Os óleos vegetais e as gorduras possuem em sua composição alta concentração de componentes graxos (triglicerídeos)2. A partir deles, podemos fazer sabão. Os óleos vegetais são extraídos de muitos vegetais, tais como: milho, soja, girassol, sementes de gergelim, amendoim, nozes, dentre outros.
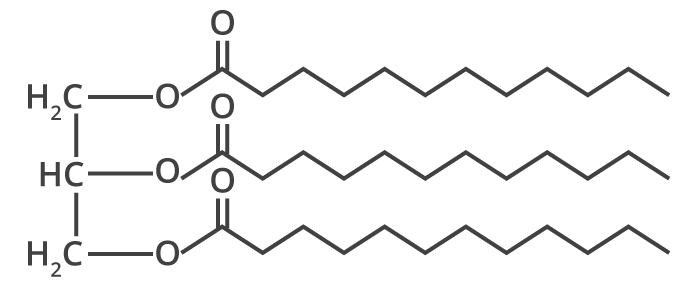
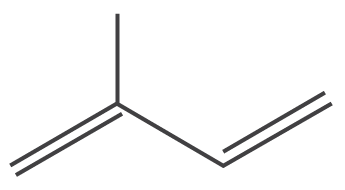
Diferentemente dos óleos vegetais, os componentes dos óleos essenciais são constituídos majoritariamente por terpenos. O que são terpenos? Os terpenos são compostos estruturados por unidades de isopreno (C5H8)3. Se um terpeno contém oxigênio, o mesmo é denominado de terpenoide, podendo apresentar diferentes funções químicas: ácidos, álcoois, aldeídos, cetonas, etc12. A principal característica dos óleos essenciais é a volatilidade2,3.
8 hidrogênios
Os terpenos podem ser definidos como “alcenos naturais”, isto é, apresentam uma dupla ligação carbono-carbono sendo caracterizado como um hidrocarboneto insaturado3.
Como extrair óleo essencial?
Os óleos essenciais podem ser extraídos de diversas partes das plantas: folhas, cascas, flores, sementes, caules e raízes1. São extraídos por hidrodestilação ou destilação por arraste a vapor. Em alguns casos, como nas frutas cítricas, o óleo essencial pode ser isolado apenas espremendo a casca. Há outros métodos de extração, como a extração por solventes e a enfleurage2.
Você já ouviu falar de óleo essencial de laranja?
Você sabe o que acontece quando esprememos uma casca de laranja? Quando esprememos uma casca de laranja com a mão, rompemos as estruturas secretoras que contém o óleo essencial. Ao fazer isso, liberamos os compostos voláteis que se aderem a nossa mão e são percebidos pelo nosso olfato.
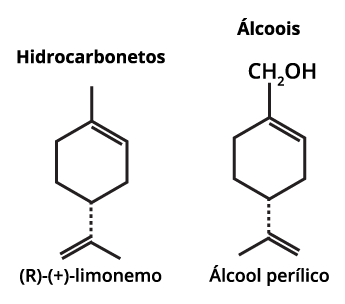
O principal componente do óleo essencial da laranja é o limoneno1.
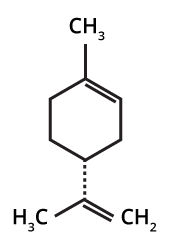
Qual a relação da indústria de suco de laranja com a extração de óleos essenciais?
Atualmente, o Brasil é o maior produtor mundial e exportador de suco de laranja. Além disso, é o maior produtor e exportador mundial do óleo essencial de laranja. O Brasil também ocupa o quinto lugar no ranking mundial como exportador de óleos essenciais4,5.
A laranja é produzida e processada em todo o mundo para a produção de diversos produtos, entre eles, o suco de laranja5.
As indústrias de suco de laranja produzem grandes quantidades de casca de laranja5. A casca de laranja é considerada um resíduo. Então, o que fazer com esses resíduos?
As cascas de laranja geralmente são enviadas para aterros (descartados no meio ambiente)6. Essa forma de descarte pode ser muito prejudicial ao meio ambiente, em função das grandes quantidades de cascas produzidas. A casca de laranja tem uma alta quantidade de carboidratos fermentáveis que aceleram a degradação das cascas e produzem uma fase aquosa que pode prejudicar a flora microbiana do solo e poluir os cursos de água6.
Você sabia que é possível fabricar ração com a casca de laranja? Porém, o processo é muito caro e pouco nutricional para o gado6. Da casca de laranja podemos extrair pectina e óleo essencial e/ou limoneno. O que é pectina? Pectina é uma substância responsável pela textura em gel de alimentos como as geléias. A extração do óleo essencial é uma das aplicações mais comuns dos resíduos da casca de laranja.

Assim, a partir da extração de óleos essenciais de laranja, é possível obter o limoneno (componente mais expressivo na casca de laranja).
Os óleos essenciais podem ser tóxicos?
Por serem compostos de formulação concentrada, é muito importante conhecer a composição química e a dosagem dos óleos essenciais7. Algumas pessoas podem ter alergias a alguns componentes do óleo essencial7 8.
O conhecimento da toxicidade do óleo essencial é muito importante e compreende diversos aspectos, tais como: dose, quantidade ou diluição do óleo essencial, frequência de uso, composição do óleo, forma de utilização e aplicação nos casos de inalação, dentre outros7.
Além disso, cada óleo essencial puro pode apresentar diferentes problemas de descarte. A maioria dos óleos essenciais são inflamáveis. Isso exige cuidado extra no momento de descartar esses produtos.
Referências
1. LIMA, F., B.; PLACEDES, J.; CARDOSO, C. R. Avaliação do rendimento dehidrodestilação para aprodução deóleo essencial das cascas de Citrus sinensis(L.) Osbeck. Revista Brasileira de Ciência, Tecnologia e Inovação, v. 4; n. 3; p. 257-266, out./dez. 2019.
2. SILVA, D. G. Isolamento e Caracterização do Óleo Essencial da Lippia Alba (Mill.) N. E. Brown (Erva Cidreira e Investigação da Atividade Biológica. 55f. Trabalho de Conclusão de Curso, Departamento de Química, Universidade Federal de Santa Catarina, 2008.
3. FELIPE, L.; O.; BICAS, J. L. Terpenos, aromas e a química dos compostos naturais. Química Nova na Escola, v. 39, n. 2, p.120-130, maio, 2017.
4. BIZZO, H. R.; HOVELL, A. M.; REZENDE, C. Óleos essenciais no Brasil: Aspectos gerais, desenvolvimento e perspectivas. Química Nova, v. 32, n. 3, p. 588-594, 2009.
5. BIZZO, H. R.; REZENDE, C. M. O mercado de óleos essenciais no Brasil e no mundo na última década. Química Nova, v. 45, n. 8, p. 949-958, 2022.
6. SUZUKI, L. L. Análise técnico-econômica e ambiental de processos de valorização do resíduo da indústria de suco de laranja. 81f. 2019. Dissertação (Mestrado em Ciências), Departamento de Engenharia Química, Escola Politécnica da Universidade de São Paulo, São Paulo, 2019.
7. MATOS, S. S. Considerações sobre a inserção do tema “contribuições da biossegurança na graduação em estética e cosmetologia” na disciplina de aromaterapia, com vistas à integridade do usuário. 64f. 2013. Monografia, Ensino em Biociências e Saúde, Curso de Especialização em Ensino em Biociências e Saúde, Instituto Oswaldo Cruz/FIOCRUZ, 2013.
8. SIMÕES, C. M. O. Farmacognosia: da planta ao medicamento. 6 ed. Porto Alegre: Editora UFSC, p.467-468, 488-495, 2010.
Desenvolvimento da página
Pesquisador: Patricia Link Rüntzel
Design: Taina Bueno
Agradecimentos: Prof.ª Dra. Juliana Barreto Brandão
Ao Projeto CNPq Pró-Humanidades 420046/2022-4 – Quimidex Ambiental – Ciência para o Desenvolvimento Sustentável








 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.