Síntese de um éster de aroma de fruta: banana
Na maior parte das vezes, o aroma encontrado em alimentos industrializados é devido a presença dos ésteres. O acetato de isoamila é o éster que confere aroma de banana aos alimentos (OLIVEIRA et al.; 2014).
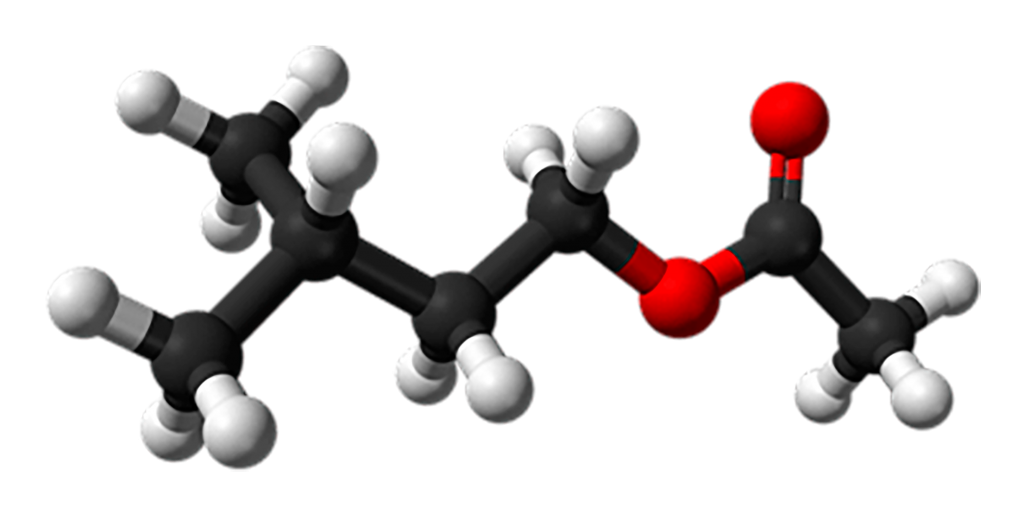
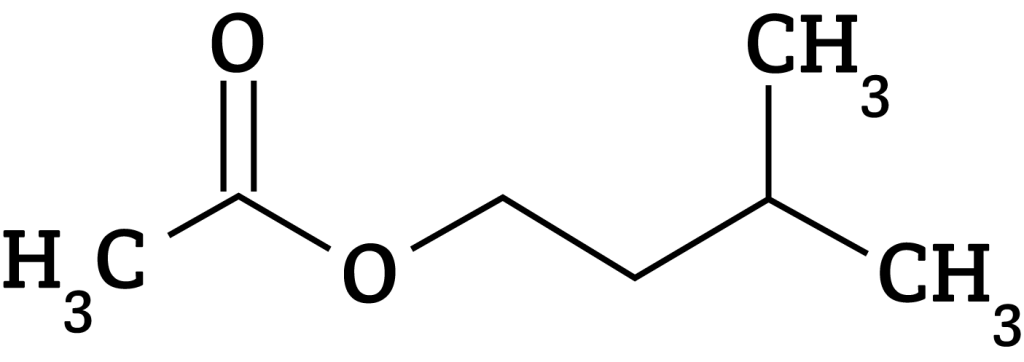
Entre os compostos encontrados na natureza, os ésteres são responsáveis pelo odor agradável de flores e frutos. Por exemplo, quando tomamos um sorvete de abacaxi, no seu preparo utiliza-se uma essência sintética que dá o gosto de abacaxi. Esses compostos possuem importantes aplicações na indústria como flavorizantes (CALVALCANTE et al.; 2015).

A bananeira usa uma mistura de compostos, incluindo o acetato de isoamila, para criar seu aroma e sabor característicos. O sabor atrai uma variedade de animais, que ajudam a dispersar as sementes das plantas em ecossistemas saudáveis. Conforme as bananas amadurecem, o acetato de isoamila é liberado – atraindo decompositores como a mosca da fruta. Você pode ver isso quando as bananas são deixadas no balcão (acervo QUIMIDEX).
Sintetizando aroma de banana mais “verde”
O método mais utilizado para obtenção de ésteres em processos industriais e em escala de laboratório é a reação reversível entre um ácido carboxílico e um álcool na presença de um catalisador. Essa reação é conhecida como Esterificação de Fischer e sem o catalisador essa reação ocorre lentamente (OLIVEIRA et al., 2014). Devido à reversibilidade da reação, também é necessário deslocar o equilíbrio para formação dos produtos, adicionando excesso de um dos reagentes, remoção do éster ou da água (OLIVEIRA et al, 2014).
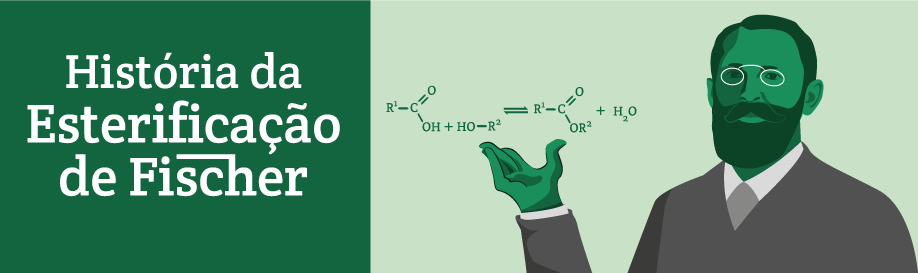
Emil Fischer e Arthur Speier escreveram pela primeira vez sobre um novo tipo de reação de esterificação em 1895. Mais tarde, ela foi denominada como a esterificação de Fischer-Speier. Suas primeiras esterificações foram realizadas com metanol e etanol na presença de ácido sulfúrico ou ácido clorídrico (Fischer e Speier, 1895).
Clique aqui para conhecer a história da esterificação de Fischer.
O acetato de isoamila sintetizado em laboratório – através da reação de esterificação de Fischer – requer o uso de ácido sulfúrico como catalisador. Para mais informações sobre o ácido sulfúrico clique aqui.

O processo catalítico convencional consiste na catálise homogênea com ácido sulfúrico, o qual permanece dissolvido no meio de reação. Neste processo, o catalisador deve ser removido ao final da reação por lavagem aquosa alcalina. Algumas das desvantagens deste método são a dificuldade de reutilização do catalisador, corrosão de reatores industriais e a liberação de resíduo para o meio ambiente. Também destaca-se que o ácido sulfúrico é um catalisador que envolve perigo elevado para a saúde e para o ambiente (OLIVEIRA et al.; 2014).
Na catálise heterogênea, o catalisador não se dissolve no meio de reação. Desta forma, o processo de separação dos catalisadores do meio, após a síntese, é de fácil execução, evitando custos associados à geração de águas residuais, podendo estes catalisadores ser reciclados e reutilizados
(OLIVEIRA et al.; 2014).
Um exemplo é a reação abaixo, com a argila montmorilonita:

Entre os tipos de argilominerais, a classe das esmectitas (montmorilonita) é a mais utilizada para fins catalíticos. Ressalta-se que a argila montmorilonita é um catalisador inócuo.
Outro exemplo é com a resina amberlyst 35:

Já as resinas são polímeros de natureza complexa. Quase sempre insolúveis em água e em solventes orgânicos, possuem grande capacidade de troca iônica. São catalisadores versáteis, menos corrosivos, resistentes a oxidação e podem ser utilizados em substituição ao seu análogo homogêneo em diversas reações orgânicas. Observa-se que a resina amberlyst 35 apresenta risco elevado para a saúde (OLIVEIRA et al.; 2014).
Os catalisadores heterogêneos podem minimizar os impactos ambientais gerados pela eliminação de rejeitos químicos quando se utiliza o ácido sulfúrico como catalisador, atendendo aos princípios da Química Verde (OLIVEIRA et al.; 2014).
Note que a água é formada pela união do grupo hidroxila (OH) do ácido carboxílico com o hidrogênio (H) do álcool. O restante da cadeia carbônica do ácido carboxílico e do álcool se unem para originar o éster.
Você conhece a relação das abelhas e do acetato de isoamila? Clique na imagem a seguir e descubra mais sobre essa relação.
Referências
BARCELOS, A. L. C.; TOLEDO, A. L. O.; JULIANI, C. M. V.; SANTOS, N. R.; OLIVEIRA, T. T.; FELIZARDO, V. J. S. Comparação dos aromas naturais versus aromas sintéticos obtidos pelo método de esterificação. In: ENCONTRO DE TECNOLOGIA, XII, 2018, Uberaba.
CALVALCANTE, P. M. M.; SILVA, R. L.; FREITAS, J. J. R.; FREITAS, J. C. R.; FREITAS FILHO, J. R. Proposta de preparação e caracterização de ésteres: um experimento de análise orgânica na graduação. Educación Química, v.26, p.319-329, 2015.
FISCHER, E., SPEIER.A. Darstellung der Ester. Chemische Berichte, 28, p. 3252–3258, 1895.
OLIVEIRA, C. A.; SOUZA, A. C. J.; SANTOS, A. P. B.; SILVA, B. V.; LACHTER, E. R.; PINTO, A. C. Síntese de Ésteres de Aromas de Frutas: Um Experimento para Cursos de Graduação dentro de um dos Princípios da Química Verde. Revista Virtual de Química, v.6, nº1, p.152-167, 2014.
Anterior








 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.