Construa as simulações e obtenha a Estrela Verde
Síntese do Ácido Acetilsalicílico
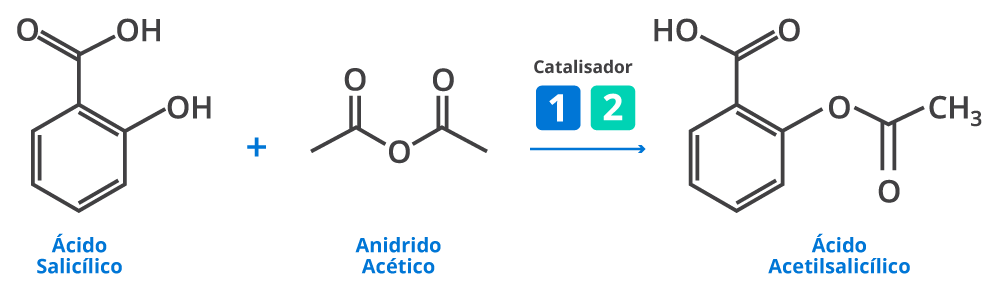
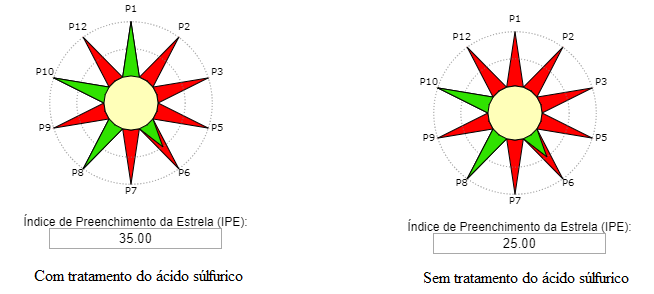
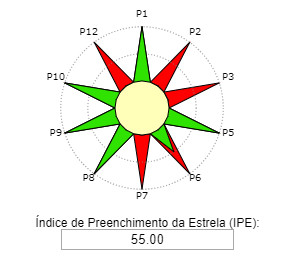
Você já sentiu dor de cabeça? Com certeza já sentiu algum tipo de mal estar, né? Possivelmente já ingeriu um comprimido de ácido acetilsalicílico e nem faz ideia. Ou ainda, já escutou alguma história de alguém que infartou do coração e foi salvo pelo breve atendimento médico. O que todas essas situações possuem em comum? Você sabe responder? Então vou te dizer… É que para todas as situações anteriormente apresentadas, é possível utilizar o ácido acetilsalicílico, popularmente conhecido como aspirina. Essa substância pode salvar vidas de pessoas que estão infartando, pois ela é capaz de afinar o sangue, o que contribui para impedir a formação de coágulos (material fabricado pelo corpo para tampar o sangramento dos vasos sanguíneos). Assim, é aconselhável que as pessoas com problemas cardíacos tenham sempre em mãos comprimidos de aspirina. Mas você sabe como a aspirina é produzida? A produção de aspirina nos permite compreender o quão importante são os catalisadores para os processos de fabricação de medicamentos. Vamos investigar dois catalisadores: (1) o ácido sulfúrico e (2) o acetato de sódio. Além disso, vamos descobrir qual a rota de produção da aspirina será mais verde. Ou seja, menos prejudicial para o meio ambiente. Para isso, iremos construir as Estrelas Verdes para o ácido sulfúrico e para o acetato de sódio. Posteriormente, vamos compara-lás.









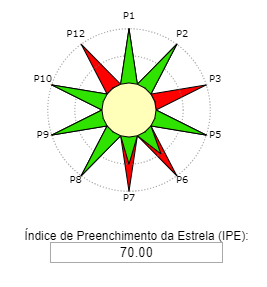
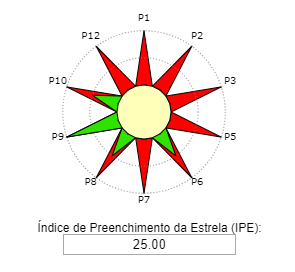

 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.