Síntese de um produto de limpeza: sabão
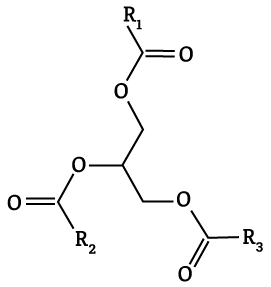
Triglicerídeos (ou Triacilgliceróis) são compostos formados por três moléculas de ácido graxo e uma molécula de glicerol (também conhecida como glicerina).
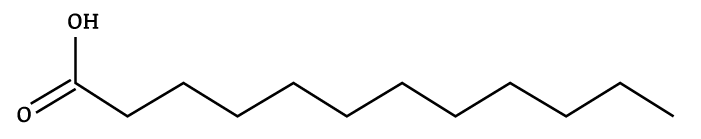
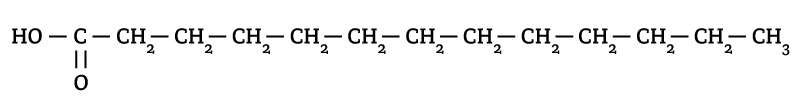
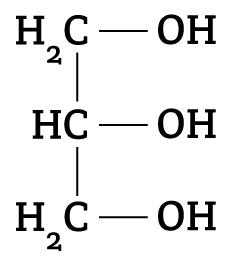
Forma-se uma molécula de triglicerídeo a partir da reação de condensação entre uma molécula de glicerol e três moléculas de ácido graxo.
Como é o processo de fabricação do sabão?
A reação química envolvida na fabricação de sabão – reação de saponificação – compõe um triglicerídeo na presença de hidróxido de sódio (soda cáustica) para formar sabão e glicerol (glicerina).

Clique aqui para conhecer a história da fabricação do sabão
A reação de saponificação é realizada na presença de bases fortes. Lembre-se que hidróxido de sódio é uma base forte.
Os sabões feitos de matérias graxas são totalmente biodegradáveis e não interferem na fauna e flora aquáticas.
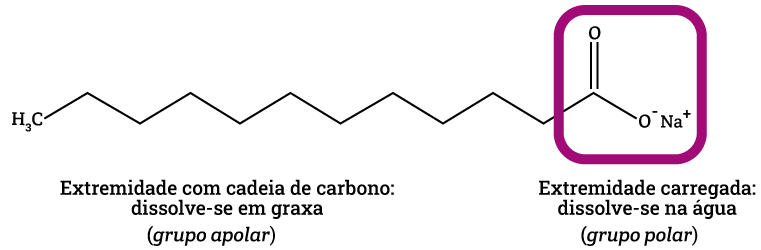
As moléculas de sabão limpam porque uma de suas extremidades é polar e solúvel em água (extremidade carboxílica -COO-), ao passo que a outra é apolar e solúvel em gorduras (extremidade mais longa). A estrutura da molécula de sabão é:
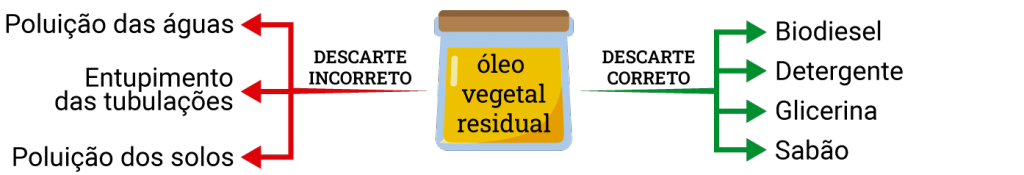
A fabricação de sabão também pode minimizar um problema ambiental: o descarte de óleo após ter sido usado como fritura. Os óleos vegetais depois de serem utilizados são descartados, muitas vezes, de forma incorreta. Quando esse óleo atinge um corpo d’ água, ele pode provocar um fenômeno conhecido como eutrofização da água. No solo, o óleo também é prejudicial, pois promove a proliferação de micro-organismos e até danos ás plantas, quando atinge suas raízes.
Referências
BARBOSA, A. B.; SILVA, R. R. Xampus. Química Nova na Escola, nº2, p.3-6, 1995.
BORSATO, D.; MOREIRA, I.; GALÃO, O. F. Detergentes Naturais e Sintéticos: um guia técnico. 2 ed. Londrina: Eduel, 2004. 182p.
WADAS, C. M.; SIMON, I.; SCARTON, L.; MACHADO, B. R. Análise dos custos do sabão caseiro x industrializado. Projeto da Universidade Regional do Noroeste do Estado do Rio Grande do Sul. Departamento de Física Estatística e Matemática – DeFEM. 2004.
Informações sobre a indústria química brasileira podem ser obtidas através do site da Abquim: www.abiquim.org.br.
Anterior







 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.