Síntese do precursor do nylon: ácido adípico
O ácido adípico é utilizado na produção do polímero “nylon 6,6”. O nylon é feito com duas unidades monômeras diferentes – uma com dois grupos ácidos e uma com dois grupos amina – alternando na cadeia.
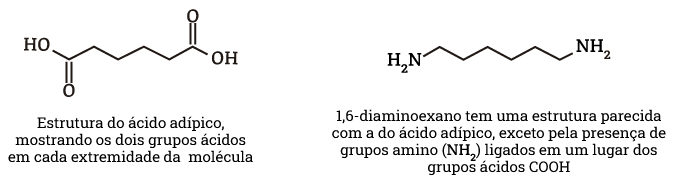
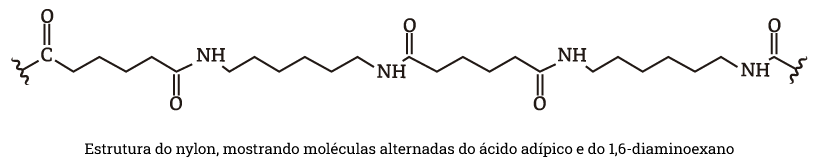
Na fabricação do nylon, ambas as extremidades amino de 1,6-diaminoexano reagem com as extremidades ácidas da molécula de ácido adípico. Isso prossegue com moléculas alternadas acrescentando-se às extremidades de uma cadeia de nylon cada vez maior. A estrutura do nylon tornou-se conhecida como “nylon 6,6” porque cada unidade de monômero tem seis átomos de carbono.
Clique aqui para conhecer a história do desenvolvimento do “nylon 6,6”
Analisando a síntese do ácido adípico, é possível identificar os impactos ambientais associados a produção do nylon. A preparação industrial do ácido adípico usa ácido nítrico, um ácido oxidante forte que apresenta muitos perigos de segurança química e riscos ambientais. O ácido nítrico pode reagir violentamente com alguns compostos orgânicos, causando sérios acidentes no laboratório. Além disso, o uso de ácido nítrico na preparação do ácido adípico resulta na emissão de óxido nitroso (N2O), um gás poluente do efeito estufa. Existem outras rotas para a obtenção do ácido adípico (Reação 1 e Reação 2). Quais destas propostas representa uma alternativa viavél a produção do ácido adípico?
Reação 1: Oxidação do ciclohexeno com permanganto de potássio (KmnO4)
Um dos métodos de obtenção do ácido adípico é a oxidação do ciclohexeno utilizando permanganato de potássio. O permanganato de potássio (KMnO4) é um exemplo de um poderoso agente oxidante. Quando dissolvido em água apresenta coloração violeta.
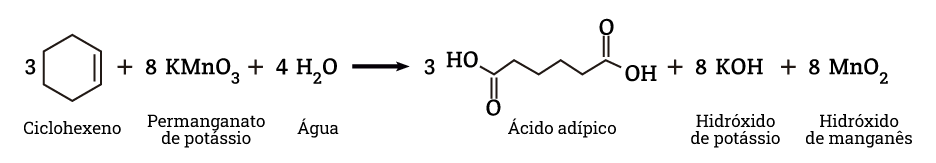
Pela figura acima, é possível observar dióxido de manganês (MnO2) e hidróxido de potássio (KOH) são subprodutos da reação. Os resíduos a base de manganês são tóxicos e podem provocar sérios danos, inclusive ao homem se descartados de forma inadequada. Antes de ser descartado, o resíduo de manganês precisa ser tratado.
Durante a reação do permangato de potássio com o ciclohexeno, a cor violeta da solução de KMnO4 desaparece. Pode ser feito um teste para verificar a presença de permanganato no meio reacional, retirando parte da mistura da reação na ponta de um bastão de vidro e tocando-o em um papel de filtro. O permanganato, se presente, aparecerá como um anel púrpura ao redor da mancha marrom escura do dióxido de manganês. Se o permanganato ainda estiver presente, adiciona-se metanol.
Neste caso, ocorrerá a oxidação do metanol. Esse processo tem como produtos intermediários o metanal e o ácido metánoico. Como o ácido metanoico ainda possui ligação de hidrogênio, ele é oxidado a ácido carbônico, H2CO3, que, por ser instavél devido a presença de diol gêmino, se decompõe em água (H2O) e gás carbônico (CO2). Assim, CO2 e H2O também são resíduos da reação. Veja cada etapa da oxidação do metanol:
Reação 2: Oxidação do ciclohexeno com peróxido de hidrogênio
Neste experimento, um procedimento de oxidação alternativo será utilizado, usando tungstato de sódio (Na2WO4.2H2O) como catalisador para a oxidação do ciclohexeno em ácido adípico pelo peróxido de hidrogênio (H2O2). Este procedimento de oxidação evita o uso do permanganato de potássio e gera apenas água como subproduto, em vez do MnO2.

Neste método, o tungstato de sódio funciona cataliticamente, sendo estruturalmente semelhante ao permanganato. Além disso, este processo utilizará um catalisador de transferência de fase (PTC), no caso o aliquat 336 (cloreto de metil-trioctil-amônio).
[(CH3CH2CH2CH2CH2CH2CH2CH2)3(CH3)N+ Cl–]
Estrutura condensada do Aliquat 336.
Como o aliquat 336 e o tungstato de sódio são catalisadores, somente o peróxido de hidrogênio é necessário como reagente estequiométrico. Observe na reação que usamos peróxido de hidrogênio em grande excesso. Como o tungstato de sódio e o aliquat 336 não são consumidos na reação, é possível reciclar estes catalisadores para uso em reações subsequentes. Só é necessário adicionar ciclohexeno e peróxido de hidrogênio à solução de catalisador reciclado para repetir a reação.
Por este método, a necessidade de solventes e a produção de resíduos tóxicos foi eliminada. Os reagentes cicloexeno e peróxido de hidrogênio não são fontes renováveis. Verefica-se uma redução no tempo total de reação, através de uma etapa.
Referências
LEONARDÃO, E. J.; FREITAG, R. A.; DABDOUB, M.J.; BATISTA, A. C. F.; SILVEIRA, C. C. “Green Chemistry” – os 12 princípios da Química Verde e sua inserção nas atividades de ensino e pesquisa. Química Nova, v. 26, nº. 1, p.123-129, 2003.
REIS, M. Química. 1 ed. São Paulo: Ática, 2013.
ZORZANELLI, B. C.; MURI, E. M. F. Oxidação de Álcoois em Química Verde. Revista Virtual Química, v.7, nº2, p.663-683, 2015.
REED, S. M.; HUTCHISON., J. E. Green Chemistry in the Organic Teaching Laboratory: W An Environmentally Benign Synthesis of Adipic Acid. Journal of Chemical Education, v. 77, nº12, dez. 2000.
Anterior



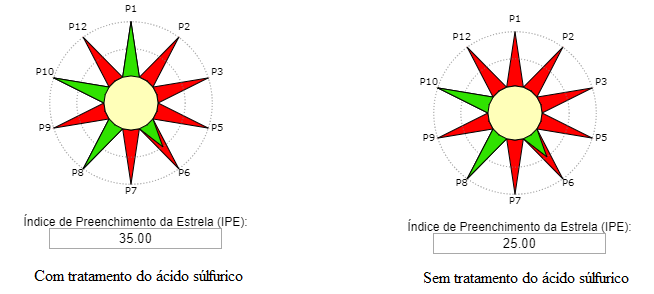

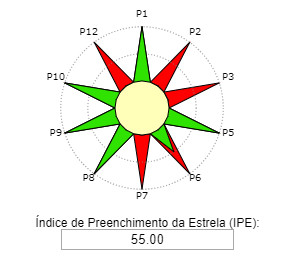



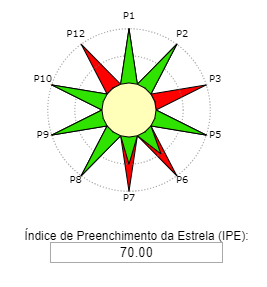
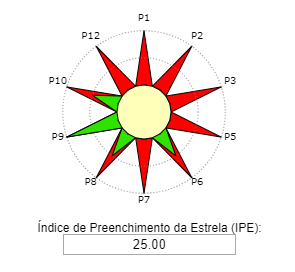

 Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.
Reação. Em um balão de fundo redondo, adicionar 0,125 mol de álcool isoamílico, 0,250 mol de ácido acético e 0,05mL de catalisador H2SO4. O condensador de refluxo foi adaptado e a mistura de reação aquecida durante 2 horas em banho de óleo na temperatura de ebulição do álcool correspondente. Após 2 horas de aquecimento, deixe a mistura reacional esfriar à temperatura ambiente.